

您的留言已提交,谢谢!
5秒后将自动关闭


摘要
为研究丙酸铬对生长奶牛葡萄糖利用的影响,采用重复拉丁方设计,对20头11-14月龄的荷斯坦小母牛分别饲喂0,5,10和15毫克/天的丙酸铬源的铬。试验包括2周的预饲期和4个分别为期2周的正饲期,每试验期之间间隔以2周的调整期,试验组和试验期的设计平衡了潜在的持续效应,丙酸铬添加于250克的玉米粉中逐头饲喂。每个试验期的第14天,试验动物安装预留颈静脉插管,并于第二天早晨进行静脉葡萄糖耐受测试。试验期体重持续增长,各处理的体重及体况评分没有变化;丙酸铬提高了血清中的基础葡萄糖含量,并降低了基础胰岛素和非酯脂肪酸(NEFA)水平,变化幅度与丙酸铬的添加量呈二次方程关系;通过测定血糖的半衰期、降至最低点所需时间以及曲下线面积发现:丙酸铬提高了葡萄糖的清除率;试验全期,胰岛素水平有降低的趋势,但其清除率没有变化;血清NEFA水平与葡萄水平呈负相关,故在此试验中葡萄糖的升高伴随着NEFA水平的降低;在第4个试验期,对照组的胰岛素水平比前几个试验期的对照组均低,这说明丙酸铬的作用是长效的。本研究结果表明丙酸铬提高了生长奶牛对葡萄糖的利用。
前言
三价铬是动物必需微量元素之一,可提高胰岛素的功能,促进胰岛素敏感器官对葡萄糖的吸收(Anderson, 1987; NRC, 1997),其缺乏会导致胰岛素抵抗和降低葡萄糖的耐受。铬参与了胰岛素信号的自身扩增,它结合到活性结构中的胰岛素受体上,从而促进葡萄糖进入胰岛素敏感细胞(Vincent, 2000,2001)。铬被认为是与一种被称为低分子量铬结合因子的小肽结合起作用的,该结合物被建议命名为含铬生物活性蛋白(Chromodulin)(Sun等, 2000; Vincent, 2000, 2001),此蛋白由氨基乙酸、半胱氨酸、天冬氨酸盐和谷氨酸盐构成,并紧密结合了4个铬离子(Vincent, 2000, 2001)。
研究表明铬会对单胃动物和反刍动物产生一系列的影响,多数结果表明铬可提高葡萄糖的耐受(NRC, 1997; Hayirli等, 2001; McNamara和Valdez, 2005)。与其它铬源相比,有机铬如丙酸铬或蛋氨酸铬的研究结果比较一致,可提高奶牛的葡萄糖利用、采食量以及产奶量(NRC, 1997; Hayirli等, 2001; McNamara和Valdez, 2005),大量的研究还发现丙酸铬在生长猪和泌乳母猪中具有同样的效果(Matthews等,2001, 2003; Shelton等, 2003)。
在奶牛产前21天至产后35天时饲喂丙酸铬,脂肪组织中的脂肪合成速度增加,净降解量降低,采食量和产奶量均得到了提高(McNamara和Valdez, 2005)。在进行丙酸铬对泌乳奶牛的作用研究之前,有必要在生长牛中利用静脉葡萄糖耐受测试(GTT)研究丙酸铬对反刍动物可能的生物活性机制。本试验的预期结果为:在静脉GTT中,通过口服添加不同剂量的丙酸铬会促进胰岛素敏感组织对葡萄糖的吸收。
y = μ + B + Ri + Cj + Tk + Sl + errorijkl
其中,μ为平均值,B为协变量(基础葡萄糖浓度、胰岛素或NEFA;葡萄糖灌注前3个点的平均值),R为行(动物)效应,C为列(试验期)效应,T为处理效应,S为区组(重复)效应。组内动物的差异及其互作在原始模型中进行了分析,由于其不显著而没有纳入到最终模型中。胰岛素在所有的测试中均存在试验期×处理的互作作用,模型包含了该效应。除组内动物因素之外,其它所有的效应都被认为是确定的。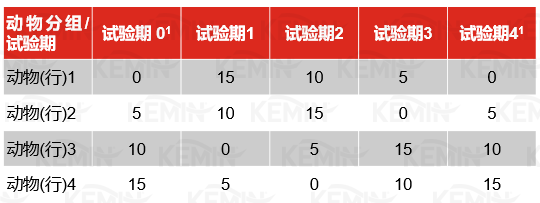
1 原始设计试验期1的血清葡萄糖测试之后,原始设计中的试验期2已经开始,在还没有进行静脉测试时,发现试验期1所采用的葡萄糖灌注量过低。调整葡萄糖灌注量并在原始设计基础上继续试验,原始设计中的试验期0在新试验中以试验期4重复进行。
第1个试验期结束后,在第2个试验期的GTT之前,分析发现葡萄糖的灌注量(0.15克/公斤体重0.75)不足,难以达到预期结果。本试验之前没有此年龄的小母牛的GTT报告,所以试验中所采用的灌注量参考的是成年动物的研究报告(Hayirli等,2001),但结果表明此剂量太低,而此时,第2个试验期已经开始且没有理由停止或重新设计并开始试验,所以从此时间点开始,葡萄糖灌注量提高到有关犊牛的研究报告水平(0.45克/公斤体重0.75)(DePew等,1998;Bunting等,2000)。于是,将原始试验设计中的第1个试验期的数据从最终分析中舍弃,原始设计中第1个试验期的试验组将被重新设计到第5个试验期中,以此完成整个试验。如此,最终的设计为完全拉丁方设计,每个试验期完成每个处理1次。
对GTT数据中葡萄糖和胰岛素变量的分析包括基础值(灌注前15,10和0分钟样本的平均值)、峰值、最低值、清除率(CR)、曲线下面积(AUC;梯形法)、半衰期(t1/2)以及回到代表真实值的基础值所需时间(T)。NEFA数据以单值的形式给出,测试每个时间点的浓度作为基础值(灌注前的平均值)和响应值(灌注后平均值减去灌注前平均值)。由于NEFA的变化为3步响应(开始由于试验操作而升高,进而随着血糖和胰岛素水平的增加而降低,最后升高至基础值)且没有适合的处理因素来衡量,所以在统计模型中没有进一步分析这些数据。
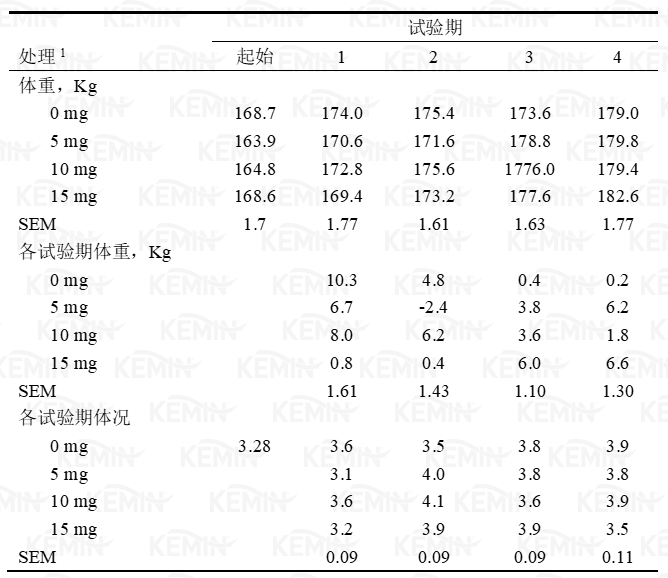
1 处理分别为对照组(0 毫克铬)、5、10或15毫克/天丙酸铬源的铬。各测定项目均没有显著差异(P>0.05).
对葡萄糖的影响
10和15毫克铬/天处理组的基础葡萄糖水平有提高的趋势(表三,图一),葡萄糖浓度水平处于已报道的泌乳牛和犊牛范围之内(Bunting等,2000;McNara和Valdez,2005)。与对照组相比,所有的指标均表明GTT测试期各处理组的葡萄糖清除率明显提高(CR,T,t1/2和AUC;表三,图1)。3个处理组的AUC降低(即更快的清除率)了36%(P=0.097)。动物间葡萄糖水平的变化差异是非常大的,据其它相关报道,发生10-20%的变化即意味着生理上发生了显著变化(Bunting等,2000;Hayirli等,2001),与此相比,本试验葡萄糖清除率的变化非常显著,此结果意味着主要胰岛素敏感组织、骨胳肌和脂肪组织对葡萄糖的吸收速度增加。
表三 丙酸铬对静脉葡萄糖耐受测试中葡萄糖相关指标的影响:葡萄糖半衰期(t1/2)、清除率(CR)、降至最低点所需时间(T)和葡萄糖曲线下面积(AUC)
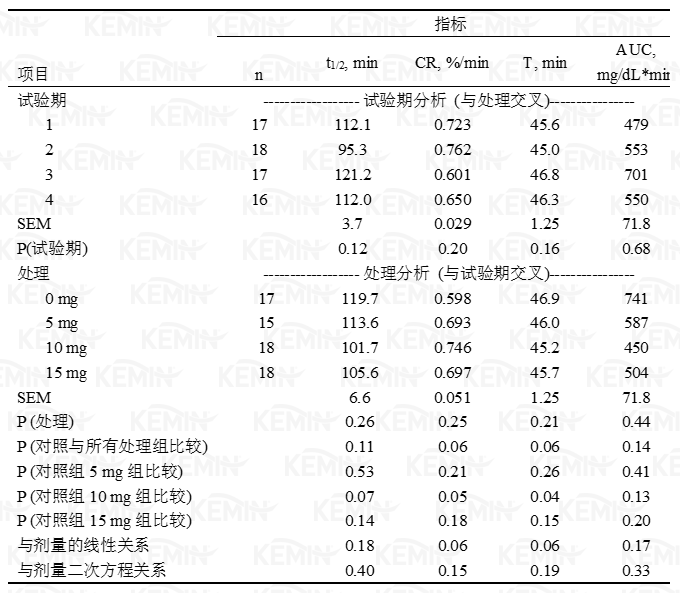
1 处理分别为对照组(0 毫克铬)、5、10或15毫克/天丙酸铬源的铬。
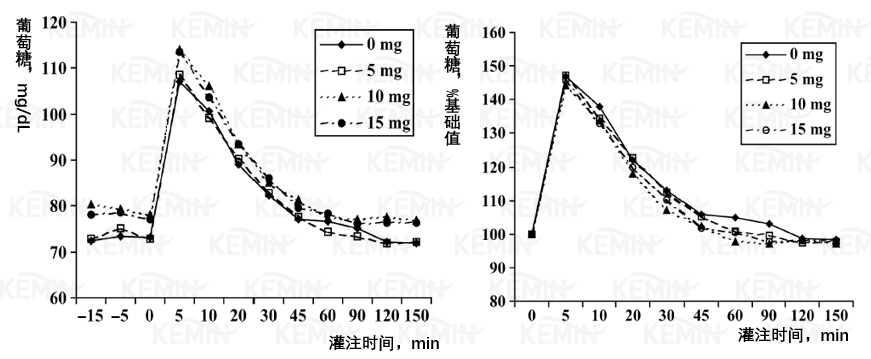
图一 丙酸铬对荷斯坦小母牛静脉葡萄糖耐受测试中葡萄糖清除的影响(左:葡萄糖绝对浓度,mg/dL;右:与其础值的百分比。各时间点的平均SEM值为1.61mg/dL或平均值的2.0%)
结果表明丙酸铬改善了胰岛素敏感性的葡萄糖吸收机制,其可能机理为:铬结合一个小分子量的小肽,在胰岛素与其受体结合之后提高了胰岛素的活性,从而提高了葡萄糖转运蛋白(可能为葡萄糖转运蛋白4,GLUT4)向细胞膜的转运(Shepher和Kahn, 1999; Cefalu等, 2002)。葡萄糖的清除率和曲线下面积结果(图2)表明影响是协同的:清除率增加,与此同时曲线下面积减小。
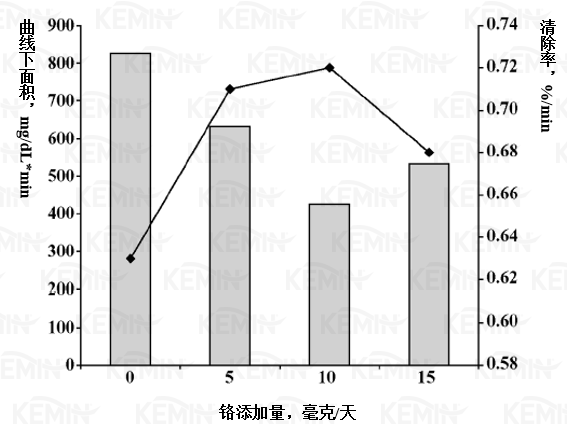
图二 丙酸铬对荷斯坦小母牛静脉测试中葡萄糖清除率和曲线下面积的影响(柱形图:曲线下面积,mg/dL*min;线形图:清除率,%/min。曲线下面积的平均SEM值为70.2mg/dL*min或平均值的1.2%;清除速度的平均SEM值为70.2mg/dL*min或平均值的4%)
对胰岛素的影响
葡萄糖灌注后血清中胰岛素水平迅速增加至峰值,达到基础值的3-4倍(表四,图3),由于各胰岛素变量均进行了处理,各组之间没有统计上的显著差异。胰岛素清除率与葡萄糖清除率结果类似,表明组织中的胰岛素敏感性提高。通过测试及分析第4试验期对照组胰岛素浓度,并与前3个试验期的结果相比,发现试验期与处理之间存在互作效应,第4个试验期的对照组结果是最低的(P<0.05,只对对照组分析试验期的影响时的所有时间点)。
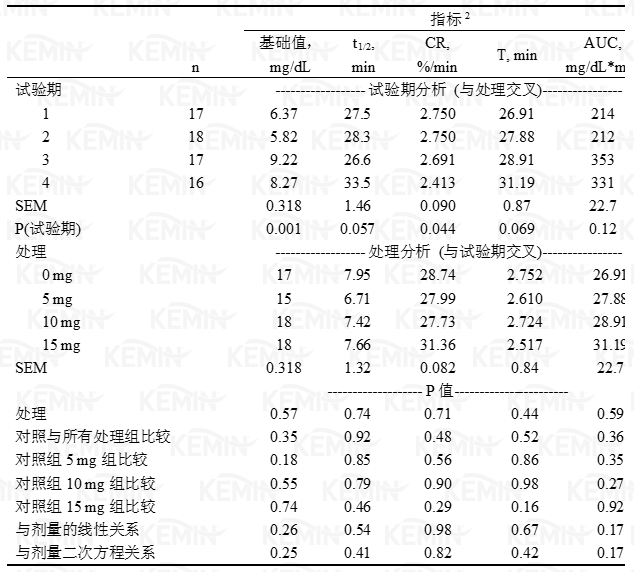
1 处理分别为对照组(0 毫克铬)、5、10或15毫克/天丙酸铬源的铬。2 指标:t1/2=半衰期,CR=清除率,T=降至最低葡萄糖浓度所需时间,AUC=葡萄糖曲线下面积
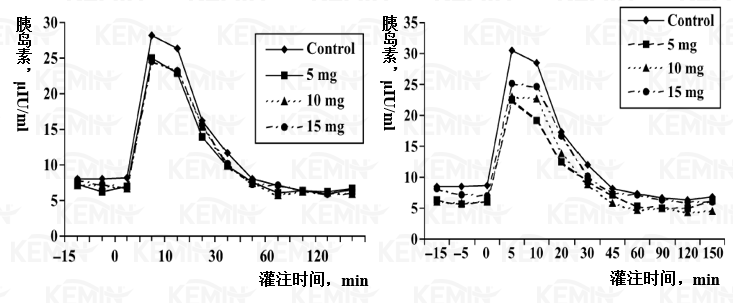
图三 丙酸铬对荷斯坦小母牛静脉测试中胰岛素的影响(左:试验全期;右:试验期1-3。各时间点的平均SEM值为1.64μIU/mL或平均值的217%)
体外葡萄糖耐受测试时,葡萄糖消失率更快但胰岛素清除率没有变化,表明组织水平上的胰岛素敏感性更高。第4个试验期对照组的胰岛素浓度显著低于前3个试验期的处理组,而第4个试验对照组的试验动物在之前6周已经饲喂了3个连续剂量的丙酸铬,且我们在试验设计时已经平衡了报道中可能存在的持续效应(NRC, 1997; McNamara和Valdez, 2005),所以如果该影响确实存在,则表明添加丙酸铬可能对胰岛素的敏感性具有长期效应。该作用需要进一步的证实,其可能机理是机体中铬的贮存增加或胰腺的敏感性得到了提高。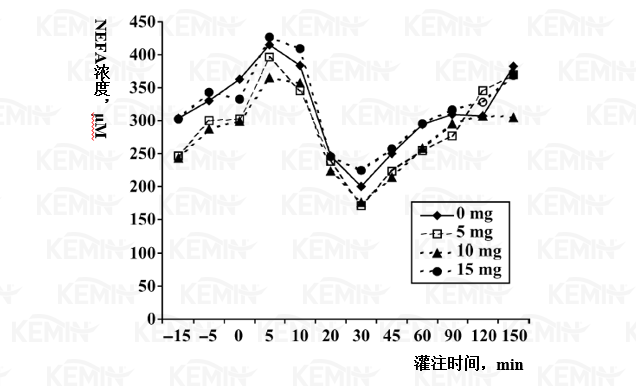
图四 丙酸铬对荷斯坦小母牛静脉葡萄糖耐受测试中非酯脂肪酸(NEFA)的影响
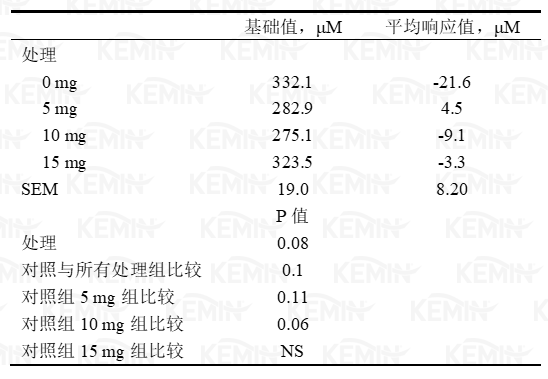
1 处理分别为对照组(0 毫克铬)、5、10或15毫克/天丙酸铬源的铬。
以往对单胃动物补饲铬的研究结果一致表明:铬可提高葡萄糖的耐受和NEFA的浓度(NRC, 1997; Matthews等,2001,2003),但反刍动物上的研究结果不太一致,许多研究表明铬可轻微提高幼年动物的葡萄糖清除率,而一些研究则发现几乎没有什么影响(NRC, 1997; Depew等,1998;Bunting等,2000)。近期对有机铬如蛋氨酸铬和丙酸铬的研究结果则较为一致:可提高妊娠晚期和泌乳期动物的葡萄糖清除率(Hayirli等,2001;McNamara和Valdez,2005)。在妊娠晚期和泌乳早期给动物供给大量的葡萄糖,就可能得到如此结果(McNamara, 2005)。这些研究结果表明效价更高的有机铬可提高反刍动物胰岛素敏感组织对葡萄糖的吸收。
铬以含铬生物活性蛋白(Chromodulin)的形式参与胰岛素敏感细胞对葡萄糖的吸收过程,含铬活性蛋白(Chromodulin)是近期对一种低分子量铬结合蛋白的建议命名(Sun等,2000)。含铬生物活性蛋白(Chromodulin)以其无金属去辅基的形式贮存于胰岛素依赖性细胞内,在响应胰岛素时,铬从血中代谢并被转运进这些细胞。铬离子进入细胞后形成含铬生物活性全蛋白,结合于胰岛素受体的活性结构上,从而扩增受体酪氨酸激酶的活性,提高信号的强度及持续时间(Jacquamet等,2003),最终增大胰岛素敏感性并将更多的葡萄糖转运至胰岛素敏感性组织,如脂肪和肌肉组织。此即为动物补充铬后葡萄糖耐受提高的原因。
迄今还有没有有关铬对肌肉和脂肪组织的影响的研究。我们过去的工作发现,对产前21天至产后35天的奶牛补充丙酸铬可大幅度(数倍)提高其脂肪细胞在体外培养时的脂肪合成速度(McNamara和Valdez,2005),脂肪降解速度则降低约10-15%,同时,释放到机体中的游离脂肪酸降低约200克/天(McNamara, 2005)。这些结果表明代谢速度发生了很大的变化,对反刍动物的这些代谢途径有一个快速且大幅度的调节(McNamara和Hillers, 1986; McNamara, 2005)。铬还提高了奶牛的采食量和产奶量(McNamara和Valdez, 2005)。尽管现在还存在“谁先发生”的问题,但以下理论似乎是比较合理的:铬提高脂肪组织对葡萄的吸收,从而降低脂肪的降解,进而导致采食速度增加,最终提高产奶量。未来的工作将可能有助于确认或推翻该理论和铬在脂肪及肌肉组织中的作用机理。
小结
经口服补充5-15毫克/天的铬提高了生长母牛对葡萄糖的利用。在标准静脉葡萄糖耐受测试中,与葡萄糖清除相关的测试结果均表明葡萄糖清除率提高,葡萄糖从血液向组织中的转运(灌注后的曲线下面积)增加。两个最主要的胰岛素敏感性器官为肌肉和脂肪,尽管在本试验日龄的母牛中,葡萄糖进入脂肪细胞的量得到了提高,但肌肉可能是最主要的葡萄糖转运对象。高葡萄糖利用率(t1/2;降到最低值所需时间)和大的曲线下面积,以及不变或稍低的胰岛素水平说明丙酸铬提高了动物对胰岛素的外围响应。
参考文献
